|
|
|
|
|
|
|
|
И.Э.Волков1, Н.Н. Скалецкий2 А.Ю. Никаноров3, С.В. Щенев1, Л.А. Кузнецова1, О.В. Стотикова1., С.А. Цыганкова1 .
Отделения диабетологии и ангиографии Республиканская Детской Клинической Больницы МЗРФ1(Москва), НИИ Трансплантологии и искусственных органов МЗРФ2(Москва), НИИ Гематологии (Москва).
Вопросы стабилизации течения инсулинзависимого сахарного диабета (ИЗСД) и борьба с его осложнениями в детском и подростковом возрасте чрезвычайно актуальны. Сложность решения этих вопросов обусловлена в значительной мере нарушением адекватного поступления инсулина в портальную систему вследствие прогрессирования аутоиммунного инсулита с одной стороны и гормональным дисбалансом пубертатного периода - с другой. Это, в свою очередь, приводит к нарушению обмена гликогена в печени и возрастанию лабильности уровня гликемии в течение суток. К сожалению, традиционная инсулинотерапия неспособна в достаточной мере решить эту проблему. Это заставило искать пути оптимизации введения инсулина, включая применение трансплантации секреторно-активных донорских островковых клеток (бета-клеток) поджелудочной железы.
Предположительно, после трансплантации островковых клеток (конечно, при условии их приживления и активного функционирования) возникают более благоприятные условия нормализации обмена гликогена в гепатоците: создается градиент концентрации инсулина между портальной системой и периферией, устанавливается обратная связь между продукцией инсулина бета-клетками трансплантата и уровнем гликемии реципиента. Это предоставляет очень хорошие возможности для достижения компенсации ИЗСД в течение длительного промежутка времени и, следовательно, для борьбы с диабетическими осложнениями.
Успешные результаты применения трансплантации культур островковых клеток, полученных из поджелудочной железы новорожденных кроликов, в комплексном лечении ИЗСД у взрослых (В.И.Шумаков, Н.Н.Скалецкий, 1995; Н.Н.Скалецкий, В.И.Шумаков, 1996) дали основание использовать этот метод в детской диабетологической практике.
В 1993-1997 гг. сотрудниками отделений диабетологии и ангиографии Республиканской детской клинической больницы МЗРФ были выполнены 28 ксенотрансплантаций культур островковых клеток детям с инсулинзависимым сахарным диабетом. В настоящей работе проводится предварительный анализ результатов проведенных трансплантаций.
МЕТОДИКА ИССЛЕДОВАНИЯ
Культуры островковых клеток были получены в лаборатории культур тканей НИИ трансплантологии и искусственных органов из поджелудочной железы новорожденных кроликов с помощью оригинального метода (Н.Н.Скалецкнй и соавт., 1990,1994), обеспечивающего высокую жизнеспособность, гормонпродуцирующую активность и резко сниженную иммуногенность трансплантата. Для приготовления 1 порции культур островковых клеток (для трансплантации 1 больному) использовали 40 поджелудочных желез новорожденных кроликов.
Реципиентами были 28 детей с ИЗСД в возрасте от 2 до 16 лет (11 мальчиков и 17 девочек) с длительностью заболевания от 6 месяцев до 12 лет (менее 1 года - 15% больных, 1-5 лет - 37%, 6-10 лет - 41%, более 10 лет -7%).
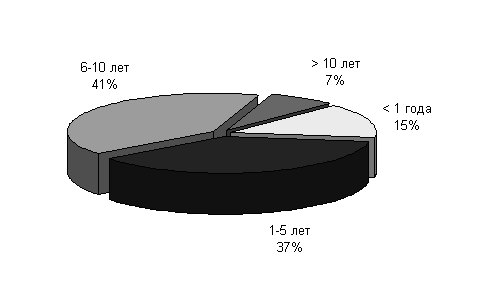
Рисунок 1 Длительность заболевания сахарным диабетом в основной группе наблюдения.
К моменту проведения трансплантации больные имели следующие вторичные осложнения сахарного диабета: хайропатия - у 19%, дистальная полинейропатия - у 19%, синдром Мориака - у 26%, катаракта - у 30%, жировой гепатоз - у 41%, нефропатия - у 51,8%, липодистрофии в местах введения инсулина - у 60%.
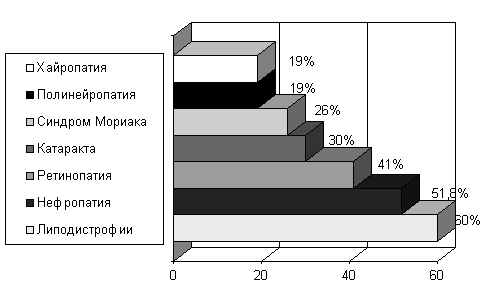
Рисунок 2 Распространенность осложнений ИЗСД в основной группе наблюдения.
Показаниями к ксенотрансплантации культур островковых клеток служили: высокая лабильность течения сахарного диабета и невозможность его стабилизации традиционными методами (у 52% реципиентов), не устраняемая наклонность к кетозу (у 37%), вторичные диабетические осложнения (у 60%), выраженное отставание в физическом и половом развитии (у 26%).
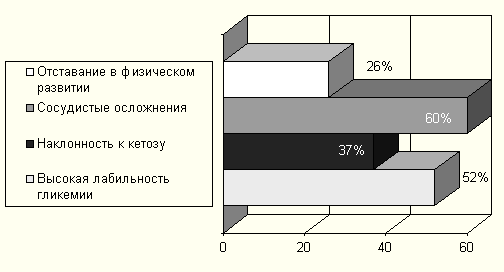
Рисунок 3 Показания к трансплантации в основной группе наблюдения.
Во всех случаях перед трансплантацией была применена интенсифицированная инсулинотерапия с целью достижения удовлетворительной клинической компенсации сахарного диабета.
Использовали несколько способов введения трансплантата в организм реципиента: под апоневроз мышц живота в 52% случаев, в паренхиму печени методом чрезкожной пункции под контролем ультразвукового аппарата со специальной насадной для пункционнолй биопсии в 22%, в портальную систему чрезселезеночным пункционным доступом под контролем ультразвукового аппарата и ангиографии - в 26% случаев.

Рисунок 4 Методы трансплантации у больных основной группы наблюдения.
У всех больных до ксенотрансплантации и через 3, 6 и 12 месяцев после нее проводили биохимический мониторинг, оценивали динамику показателей степени компенсации инсулинзависимого сахарного диабета (среднесуточная гликемия, содержание гликированного гемоглобина фракция С - НЬА1с). У части реципиентов исследовали концентрацию С-пептида в сыворотке крови натощак и после стимуляции стандартным завтраком. Проводилось стационарное обследование больных с целью выявления и оценки выраженности осложнений до трансплантации и через 3, 6 и 12 месяцев после нее.
Длительность катамнестического посттрансплантационного наблюдения составила к моменту написания настоящего сообщения у 7 реципиентов 1 год, у 16 реципиентов - 2 года, у 2 больных - 3 года, у 1 больного - 4 года и у 1 реципиента - около 5 лет.
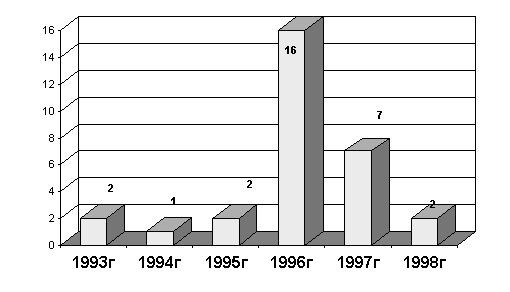
Рисунок 5. Длительность катамнестического наблюдения за реципиентами.
РЕЗУЛЬТАТЫ ИССЛЕДОВАНИЯ
После ксенотрансплантации культур островковых клеток во всех случаях наблюдалась стабилизация течения инсулинзависимого сахарного диабета. До пересадки у большинства больных была неудовлетворительная степень компенсации заболевания, о чем свидетельствовал средний уровень НЬА1с - 11,37%. К 3 месяцу после трансплантации содержание НЬА1с уменьшилось в среднем на 1 % и составило 10,23% от исходного уровня. У одного из больных в дальнейшем было отмечено резкое снижение содержания НЬА1с - до 7,8%, что составило 55% от исходного уровня (14,2 %). К 12 месяцу после трансплантации у реципиентов отмечалось нарастание среднего уровня НЬА1с, но его значение оказалось все же ниже дотрансплантацнонного (10,82%).
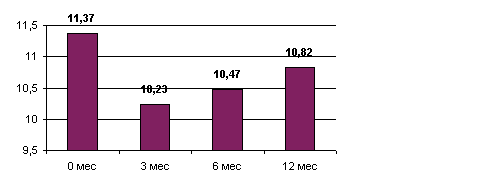
Рисунок 6 Динамика усредненных величин HBA1c.
В соответствии с международными критериями, отраженными в Европейском консенсусе, больной с сахарным диабетом считается хорошо компенсированным если уровень гликированного гемоглобина ниже 8%, удовлетворительно - 9%. В этой связи количество больных компенсированных удовлетворительно менее 7% до трансплантации. Через 3 месяца после ксеногенной трансплантации у 31,5% больных была достигнута удовлетворительная компенсация ( HBA1c менее 9%), причем 10% имела уровень гликированного гемоглобина ниже 8%. Через год после ксенотрансплантации - 25% больных удовлетворительно компенсированы (HBA1c<9%), а 12,5% из них - хорошо (HBA1c<8%).
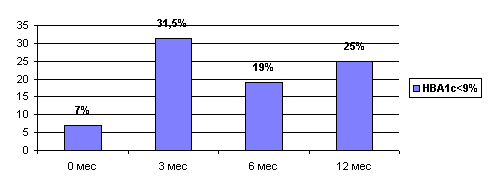
Рисунок 7 Степень компенсации сахарного диабета по HBA1c.
Если до трансплантации трудности в достижении компенсации сахарного диабета испытывали 68% реципиентов, то к 3 и 6 мес. после операции эти проблемы были уже менее чем у половины больных (43% и 42% соответственно), а к 12 мес. - лишь у 33%.
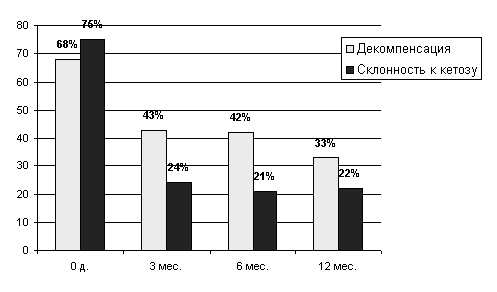
Рисунок 8 Динамика частоты декомпенсаций сахарного диабета и наклонности к кетозу после ксенотрансплантации.
На фоне стабилизации течения сахарного диабета уже к 3 месяцу после трансплантации наклонность к кетозу сократилась с 75% до 24%.
Клинически функцию трансплантата косвенно оценивали по наклонности к развитию гипогликемий (имеются ввиду легкие гипогликемии, требующие коррекции дозы вводимого инсулина). Если до трансплантации наклонность к гипогликемиям имела место лишь у 4% больных, ток 3 месяцу после пересадки эта тенденция отмечалась уже у 33% реципиентов. К концу 1 года после трансплантации наклонность к гипогликемиям сохранялась у 20% больных.
При этом происходило снижение потребности в экзогенном инсулине в среднем на 0,1 ед на 1кг массы тела к 6 месяцу после ксенотрансплантации (максимально - на 0,3 ед/кг, или уменьшение дозы вводимого инсулина на 43% от исходного уровня). Следует отметить, что у 2 детей в пострансплантационном периоде (на амбулаторном режиме) были зафиксированы тяжелые гипогликемические состояния, возникновение которых было обусловлено проведением неадекватной инсулинотерапии (избыточное введение экзогенного инсулина на фоне активной функции трансплантата) из-за недостаточного обучения больных и не обеспечения их средствами самоконтроля.
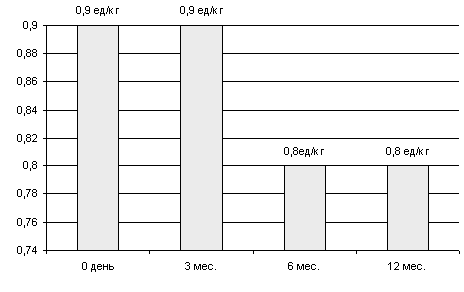
Рисунок 9 Потребность в инсулине после ксенотрансплантации.
Структурный анализ свидетельствует о снижении потребности в инсулине у половины реципиентов уже к 3 месяцу после ксеногенной транплантации. Данный эффект сохраняется в течение года.
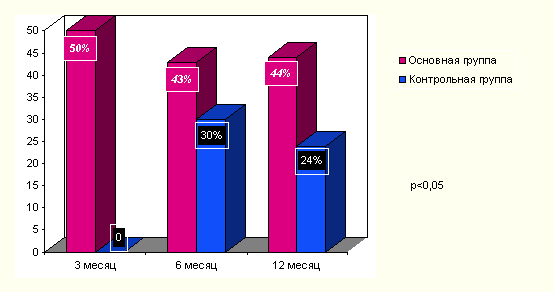 Рисунок
10 Снижение потребности в инсулине
в основной и контрольной группах
Рисунок
10 Снижение потребности в инсулине
в основной и контрольной группах
По-видимому, трансплантация культур островковых клеток новорожденных кроликов не оказывает значительного воздействия на секрецию инсулина собственными бета-клетоками реципиента. Стандартные коммерческие наборы не выявляет С-пептид кролика, динамика С-пептида у больных инсулинзависимым сахарным диабетом, после трансплантации островковых клеток поджелудочной железы кролика, может свидетельствовать о гормональной активности только собственных бета-клеток реципиента. У исследованной группы больных уровень базального и стимулированного С-пептида до ксенотрансплантации составлял в среднем соответственно 0,38 пмоль/мл и 0,42 пмоль/мл, а после нее - постепенное снижение уровня базального и стимулированного С-пептида к 6 месяцу до 0,22 пмоль/мл и 0,23 пмоль/мл.
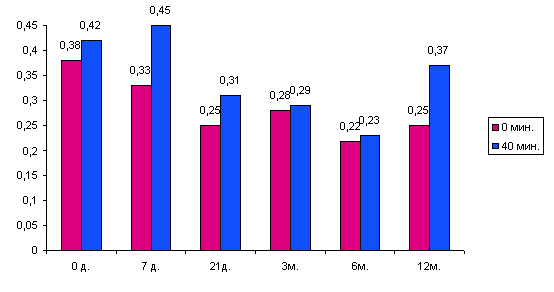
Рисунок 11 Динамика С-пептида после трансплантации.
При офтальмоскопии перед проведением ксенотрансплантации у 40,7% реципиентов выявлялись изменения на глазном дне, расцениваемые офтальмологом, как непролиферативная ретинопатия. После проведения ксенотрансплантации культуры островковых клеток поджелудочной железы происходило постепенное снижение частоты данного осложнения до 34,5%, 31,8%, 25% на 3, 6, 12 месяц после операции соответственно. Максимальное снижение частоты ретинопатии отмечено к году после трансплантации на 15,7% от исходного уровня.
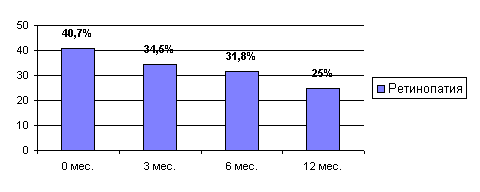
Рисунок 12 Динамика частоты диабетической ретинопатии после ксенотрансплантации.
Частота диабетической нефропатии, диагностируемой по наличию повышенной экскреции альбумина с мочой, после трансплантации культур островковых клеток уменьшилась более чем в 2 раза - с 51,8% до 31,3% к году после проведения трансплантации.
 Рисунок
13 Динамика частоты диабетической нефропатии после ксенотрансплантации
Рисунок
13 Динамика частоты диабетической нефропатии после ксенотрансплантации
Выраженность альбуминурии к 12 мес. после пересадки снизилась в среднем почти в 3 раза - с 207,4 мг/ сут. до 78,7 мг/сут.
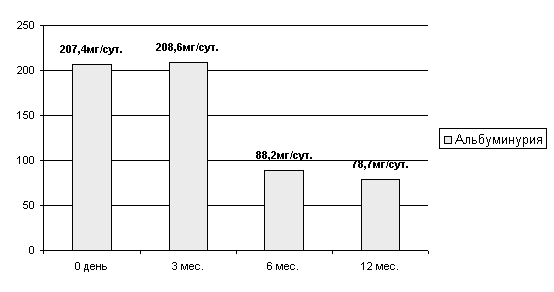 Рисунок
14 Выраженность альбуминурии у больных с диабетической нефропатией
Рисунок
14 Выраженность альбуминурии у больных с диабетической нефропатией
Это привело к значительному сокращению частоты нефропатии в стадии макроальбуминурии и микропротеинурии в группе наблюдавшихся больных.
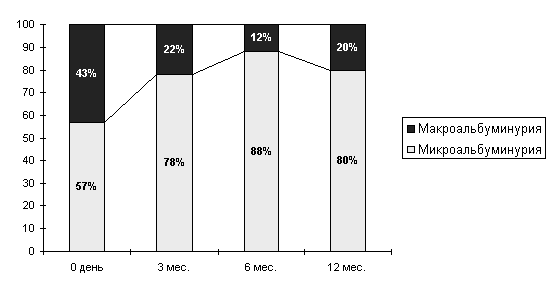 Рисунок
15 Структура тяжести нефропатии после ксенотрансплантации.
Рисунок
15 Структура тяжести нефропатии после ксенотрансплантации.
Следует отметить, что уменьшение выраженности диабетической нефропатии не было обусловлено именно улучшением компенсации нарушенного углеводного обмена, так как у реципиентов не было отмечено корреляционной зависимости между снижением содержания HЬА1с и уменьшением альбуминурии.
 Рисунок
16 Зависимость частоты нефропатии от степени компенсации сахарного диабета
после ксенотрансплантации.
Рисунок
16 Зависимость частоты нефропатии от степени компенсации сахарного диабета
после ксенотрансплантации.
Это свидетельствует о воздействии ранее не учитывавшегося фактора, появляющегося после трансплантации островковых клеток. По нашему мнению, позитивное влияние пересадки на возникновение и течение вторичных диабетических осложнений обусловлено активной секрецией бета-клетками трансплантата и частично восстановившимися собственными бета-клетками реципиента С-пептида, обладающего, по-видимому) выраженным ангиопротективным действием J. Wahren е1 а1„ 1994).
В результате проведения ксенотрансплантации почти в 3 раза сократилось число детей с задержкой роста (с 33% до 12% к 6 мес.). Среднее увеличение роста реципиентов со стойкой задержкой физического развития составило 6,1 см в год, что соответствует нормальным темпам роста. Максимальная прибавка в росте составила 16 см/год.
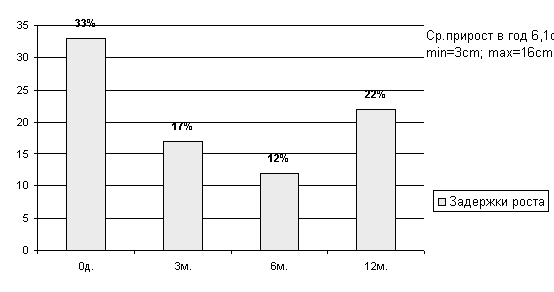 Рисунок
17 Динамика нарушений роста у больных после ксенотрансплантации.
Рисунок
17 Динамика нарушений роста у больных после ксенотрансплантации.
В посттрансплантационном периоде при различных способах введения трансплантата отрицательной динамики биохимических показателей зафиксировано не было.
Проведенный анализ предварительных результатов выполненных нами трансплантаций культур островковых клеток поджелудочной железы новорожденных кроликов детям с инсулинзависимым сахарным диабетом позволил сделать следующие выводы:
1. Ксенотрансплантация культур островковых клеток оказывает стабилизирующее влияние на течение сахарного диабета у детей, о чем свидетельствуют динамика HЬА1с, уменьшение наклонности к развитию кетоза, снижение частоты декомпенсаций.
2. Эффективны все три использованных способа введения трансплантата, однако внутримышечный предпочтительнее из-за его простоты и безопасности.
3. Начало функционирования трансплантированных островковых клеток, оцениваемое по появлению наклонности к гипогликемиям и динамике дозы вводимого инсулина, определяется на 2-3 мес. после пересадки, и длительность функционирования составляет 8-10 мес.
4. Положительное влияние трансплантации культур островковых клеток на вторичные осложнения ИЗСД отмечается через 3-6 мес. после пересадки. Наиболее заметный посттрансплантационный лечебный эффект наблюдается у больных с диабетической нефропатией, ретинопатией и с синдромом Мориака.
ЛИТЕРАТУРА
1. Скалецкнй Н.Н., Кирсанова Л.А„ Блюмкин В.Н. //Проблемы транспланологии и искусственных органов. - М., 1994. - С. 73-80.
2. Скалецкий Н.Н„ Кирсанова Л.А„ Загребина О.В. и др. // Трансплантация органов. - Львов, 1990. - С. 124-125.
3. Скалецкий Н.Н„ Шумаков В.Н. // Трансплантация фетальных тканей и клеток человека. - М, 1996. - С. 33-40.
4. Шумаков В.Н. Скалецкий Н.Н. // Трансплантология. Руководство. / под ред. В.И.Шумакова.-М„ 1995.-С. 317-331.
5. Wahren J., Johansson B., Wallberg-Henriksson H/ // Diabetologia. - 1994. -37,8 Sappl.2.-Р. 99-107.
РЕЗЮМЕ
Проанализированы предварительные результаты 28 ксеногенных трансплантаций культур островковых клеток детям с инсулинзависимым сахарным диабетом (ИЗСД). Культуры островковых клеток были получены из поджелудочной железы новорожденных кроликов с помощью оригинального метода. Реципиентами были 28 детей с ИЗСД в возрасте от 2 до 16 лет (9 мальчиков и 17 девочек) с длительностью заболевания от 6 мес. до 12 лет. Показаниями к трансплантации служили высокая лабильность течения ИЗСД и невозможность его стабилизации традиционными методами, не устраняемая наклонность к кетозу, вторичные диабетические осложнения, в том числе диабетические нефропатия и ретинопатия, выраженное отставание в физическом и половом развитии (синдром Мориака). После ксенотрансплантации во всех случаях наблюдалась стабилизация течения ИЗСД, у большинства больных исчезала наклонность к кетозу. При этом снижалось содержание гликированного гемоглобина (НЬА1с), уменьшалась потребность в экзогенном инсулине. Отмечено лечебное действие трансплантации культур островковых клеток на вторичные осложнения ИЗСД. Так, у больных с диабетической нефропатией экскреция альбумина с мочой снизилась в среднем почти в 4 раза - с 207 мг/сут. до 78,7 мг/сут. У больных синдромом Мориака восстановилась нормальная прибавка в росте - в среднем 6,1 см в год (максимальный результат - 16 см/год). По-видимому, позитивное влияние на вторичные осложнения обусловлено, в основном, ангиопротективным действием С-пептида, секретирумого бета-клетками трансплантата.
27 Июль 1998